



Artículos originales
Evaluación de dos técnicas de decoloración en raíces para determinación de simbiosis micorrícica en banano (Musa spp.)
Evaluation of two root bleaching techniques to determine mycorrhizal symbiosis in banana (Musa spp.)
Temas Agrarios
Universidad de Córdoba, Colombia
ISSN: 0122-7610
ISSN-e: 2389-9182
Periodicidad: Semestral
vol. 27, núm. 2, 2022
Recepción: 27 Diciembre 2022
Aprobación: 30 Diciembre 2022

Resumen: Para la identificación de la simbiosis entre la raíz y hongos micorrícicos arbusculares (HMA), se reportan metodologías con variaciones en concentraciones de reactivos, temperatura y tiempo de exposición en la tinción, lo que no siempre se ajusta a la necesidad de cultivos específicos debido a la variación en las estructuras de las raíces. El objetivo del presente trabajo fue estandarizar una metodología para identificación de colonización micorrícica en cultivos de banano con una forma práctica y ágil. La investigación se desarrolló durante el segundo semestre del 2022 en el municipio de Apartadó-Antioquia. Se establecieron 4 tratamientos que consistieron en la evaluación con y sin inoculación micorrícica con dos técnicas de decoloración cada uno (con y sin sometimiento a baño María). Se evaluó un total de 108 placas (54/técnica) donde se identificó porcentaje de colonización, visibilidad, vesículas y arbúsculos. El diseño experimental fue completamente al azar. La información se procesó con el software R Studio 2022.02. Se obtuvo un ANAVA y comparación de medias con un análisis post-hoc de Tukey y Kruskal- Wallis con un nivel de confianza del 95%. En todos los casos se encontró simbiosis, se identificaron diferencias estadísticas en porcentaje de colonización con valores entre 46,8% - 90,2%; arbúsculos entre 12,1 - 338,0 unidades y porcentaje de visibilidad del 100% en tratamientos sometidos a baño María, resaltando la necesidad del sometimiento a calor en raíces de banano para favorecer la decoloración, tinción y visibilidad debido a su arquitectura.
Palabras clave: Estandarizar Metodología, Musáceas, Porcentaje De Colonización, Baño María, Clareamiento, Tinción..
Abstract: To identify symbiosis between roots and arbuscular mycorrhizal fungi (HMA), methodologies have been reported with variations in concentrations of reagents, temperature, and time of exposure for staining, which does not always adjust to the need for specific cultures due to variation in root structures. The objective of this research was to standardize a methodology to identify mycorrhizal colonization in banana crops in an efficient way. The research was carried out during the second semester of 2022 in the municipality of Apartadó- Antioquia. Four treatments were established that consisted of the evaluation with and without mycorrhizal inoculation with two bleaching techniques each (with and without subjection to Bain Marie). A total of 108 plates (54/technique) were evaluated, where percentage of colonization, visibility, vesicles and arbuscules were identified. There was a complete randomized design. Data were analyzed with R Studio 2022.02 software. An ANAVA and means separations were obtained with a post-hoc analysis of Tukey and Kruskal-Wallis with a confidence level of 95%. Symbiosis was found in all cases, statistical differences were identified in percentage of colonization with 46.8% to 90.2%; arbuscules from 12.1 to 338.0 units and a visibility percentage of 100% in treatments subjected to a Bain Marie, highlighting the need for subjecting banana roots to heat to favor discoloration, staining and visibility due to their architecture.
Keywords: Standardize Methodology, Musaceae, Colonization Percentage, Water Bath, Clearing, Staining.
INTRODUCCIÓN
Las micorrizas son asociaciones simbióticas benéficas entre las raíces de las plantas y hongos del suelo que se encuentran en todos los ecosistemas terrestres, desde los polos hasta los desiertos, y se estima que más de 80% de las plantas son capaces de presentar una relación simbiótica con estos hongos del suelo (Carrillo-Saucedo et al., 2022). En particular, los hongos micorrícicos arbusculares (HMA) han ganado un gran interés como insumo biológico en los agroecosistemas (Bernal- Monterrosa, 2020; Ducousso-Détrez et al., 2022).
Los HMA pueden mejorar la absorción de nutrientes minerales de sus plantas hospedantes aumentando el área de superficie de absorción y movilizando nutrientes minerales poco móviles como el fósforo (P), cobre (Cu), zinc (Zn), pero también puede favorecer al transporte de potasio (K) y nitrógeno (N) (Lima, 2020; Liu et al., 2022). A cambio, la planta huésped puede proporcionar el carbono (C) necesario para que crezcan los HMA (Ren et al., 2022). En esta simbiosis mutualista, la planta estimula la producción de fitohormonas, mejora las tasas fotosintéticas, el flujo de transpiración, absorción de agua, aclimatación-desarrollo en campo y fortalece el sistema de defensa frente a los agentes patógenos (Aires-dos Santos et al., 2020; Naranjo-Moran et al., 2022; Sepúlveda Vargas, 2020), caso que no es ajeno al cultivo de banano (Bernal-Monterrosa y Cabrales-Herrera, 2022; Kasaka et al., 2022; Rashad et al., 2021; Simó-González et al., 2020).
La evaluación de los HMA puede obedecer a diferentes fines: a) observar la colonización por HMA en forma natural, b) hacer seguimiento al grado de establecimiento de HMA introducidos (infectividad, en ambos casos) c) evaluar efecto de tratamientos al correlacionarlos con colonización y variables de desarrollo vegetal como productividad (efectividad), d) correlación de su presencia con variables de naturaleza fisiológica y molecular, e) estudios avanzados de microscopía: de barrido (SEM) o de transmisión (TEM) entre otros (Sánchez de Prager et al., 2010). En todos los casos, el procedimiento para determinar colonización de HMA puede generar variabilidad en los resultados conllevando a un diagnóstico erróneo, debido a que la simbiosis entre la planta y el hongo requiere de un reconocimiento y una armonización de procesos en el espacio y en el tiempo que son complejos (Gonzalez et al., 2018).
En los procedimientos o metodologías para observar la presencia de la simbiosis y de las estructuras de los HMA, contemplan que las muestras se sometan a: a) clareamiento, b) blanqueo, c) acidificación, d) tinción y e) eliminación de excesos de colorante (Phillips y Hayman, 1970). A partir de ahí, se han generado múltiples modificaciones que consisten en variar concentraciones de reactivos, tiempos de sometimiento a calor, temperatura (Cottet et al., 2018), determinaciones micromorfológicas - culturales (Soroa-Bell et al., 2009) y para tinción, en vista de que el azul de tripano es un reactivo considerado carcinógeno, según la Agencia Internacional para Investigaciones sobre el Cáncer. También se emplean con frecuencia otras técnicas basadas en el uso de presuntos carcinógenos como el clorazol negro E y la fucsina ácida (Rodríguez-Yon et al., 2015), para lo cual, se ha planteado su sustitución por tinta china (Aguilar-Ulloa et al., 2016) sin determinar en qué tipo de especies resultan ser efectivas estas modificaciones o no. Adicionalmente, no se reporta una metodología estandarizada para determinar simbiosis en el cultivo de banano.
El objetivo del presente trabajo fue estandarizar una metodología para identificación de colonización micorrícica en cultivos de banano con una forma práctica y ágil, permitiendo mejorar la visibilidad de estructuras optimizando el tiempo en montaje y lectura de muestras.
MATERIALES Y MÉTODOS
Lugar y época de estudio
La investigación se desarrolló durante el segundo semestre del 2022 en el departamento de Antioquia, municipio de Apartadó. En la fase de campo, las muestras para identificación de simbiosis fueron tomadas en la finca Altavista, lotes 14 y 15, cada lote con un área comprendida por 7 ha y densidad poblacional de 1750 plantas ha-1, ubicada con coordenadas geográficas: 7° 86' 07'' de latitud N y 76° 65' 91''de longitud W. La zonificación climática que caracteriza a la zona es de “Clima cálido húmedo”, esparcida en el centro de la región de Urabá (Bernal Monterrosa y Delgado Bejarano, 2022), esta zona presenta las siguientes características agroclimáticas: 2.660 mm anuales, temperatura promedia de 28 °C, altitud de 31 m.s.n.m. y una evapotranspiración de 1.300 mm anuales en promedio (Instituto de Hidrología Metereología y Estudios Ambientales (IDEAM), 2022; Instituto Geográfico Agustín Codazzi (IGAC), 2007). La fase de laboratorio fue realizada en el laboratorio del Centro de investigaciones del banano (Cenibanano), ubicado en el conjunto residencial Los Almendros km4 vía Carepa. Bajo condiciones controladas.
Características fisicoquímicas del suelo
El análisis de suelos se hizo con base a los métodos analíticos utilizados en la Universidad de Córdoba (IGAC, 2006).
Se usaron los siguientes métodos, para pH: Potenciometría relación suelo: agua 1:1; materia orgánica (MO): Walkley y Black; P: Bray II; azufre (S): monofosfato de calcio; bases (calcio (Ca), magnesio (Mg), potasio (K) y sodio (Na)): extracción con acetato de NH4 1M y pH 7; Al: cloruro de potasio (KCl); microelementos (cobre (Cu), hierro (Fe), zinc (Zn), manganeso (Mn) y boro (B)): doble ácido.
Inoculación con hongos micorrícicos arbusculares HMA
Se hizo al momento del trasplante a campo, se aplicó en el sitio de siembra 100 g de micorriza comercial antes de sembrar las plántulas. La inoculación de HMA se realizó en el lote 14, dejando lote 15 sin aplicación como testigo. El producto usado contiene los géneros Acaullospora, Glomus, Entrophospora y Scutellospora según la etiqueta del fabricante. El manejo agronómico y fitosanitario se estableció con base en el protocolo de políticas del grupo Agrosiete S.A.S.
Muestreo de raíces
La toma de muestras de raíces se realizó utilizando la metodología propuesta por Vargas y Araya (2018). Para el muestreo, las plantas contaron con las siguientes características: planta madre en e stado de floración, máximo con ocho días de haber emitido la inflorescencia y el hijo de sucesión mínimo en etapa fenológica de F10 según la descripción de Mira Castillo y Sánchez Torres (2013). Una vez cumplidas estas especificaciones, se cavó un hoyo en forma rectangular, cerca de la base del pseudotallo, orientadas en el intervalo entre la planta madre y su hijo de sucesión, con las siguientes dimensiones 17 cm de longitud, 17 cm de ancho y 25 cm de profundidad (palín tamaño universal). Posteriormente se realizó una disgregación para obtener las raíces, se lavaron para eliminar impurezas y excesos de suelo. Se clasificaron y tomaron raicillas delgadas de cada planta por tratamiento y se introdujeron en agua destilada para evitar la desecación.
Evaluación de la colonización micorrícica
Se midió porcentaje de colonización (PCOL), porcentaje de visibilidad (PVIS), numero de vesículas (NVES) y número de arbúsculos (NARB).
El procedimiento se hizo mediante la técnica Phillips utilizada por Vallejos-Torres et al., (2019) en su investigación. Esta es la técnica tradicional y se denominó “rápida” en el ensayo. Para la aclaración de raíces se sumergieron en una solución de KOH al 10% en baño María a 60°C durante 10 minutos (min), posteriormente se enjuagaron dos veces durante dos minutos en una solución de HCl al 10%, hasta tornarse de color blanco claro. En la tinción se implementó una solución de azul de tripano en alcohol en partes iguales, se introdujeron las raíces y se colocaron en baño María por 10 min a 60°C.
La segunda técnica se denominó “24 h”, fue utilizada por Newsham et al. (2014) y citado por Cottet et al., (2018), donde se usaron los mismos reactivos, la variación consistió en dejar las muestras sumergidas en KOH al 10% durante 24 h a temperatura ambiente, suprimiendo el baño María tanto en aclaración como en tinción.
Porcentaje de colonización PCOL: se hizo lectura en el microscopio a lo largo del portaobjeto, se marcaron como lecturas positivas los segmentos donde se encontraba la colonización y negativas donde no la había. La suma conformó la totalidad de los segmentos y se expresaron en porcentaje. La evaluación se hizo mediante la ecuación 1 (Ec 1).

Porcentaje de visibilidad PVIS: se hizo lectura en el microscopio similar a PCOL, se contaron segmentos visibles y no visibles, la suma conformaba la totalidad de los segmentos, expresada en porcentaje. La evaluación se hizo mediante la ecuación (Ec 2).
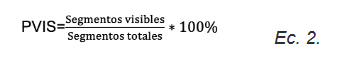
Número de vesículas NVES y de arbúsculos NARB: se contaron las vesículas y arbúsculos encontrados en los interceptos positivos en la lectura de la colonización, y se expresaron como unidades de vesículas o arbúsculos/placa.
Tratamientos
Se establecieron 4 tratamientos, consistieron en evaluar la técnica “rápida”, con baño María durante 10 min a 60°C y la técnica “24 h”, dejando el material sumergido en KOH al 10% durante 24 h a temperatura ambiente. Los tratamientos se describen en la tabla 1:
| Inoculación con micorrizas | Técnica | Denominación |
| Si | Rápida | CM-1 |
| Si | 24 h | CM-2 |
| No | Rápida | SM-1 |
| No | 24 h | SM-2 |
Cada tratamiento tuvo tres repeticiones, cada repetición correspondió al muestreo radicular de una planta para un total de doce unidades obtenidas de forma aleatorizada en campo. De cada unidad se obtuvo nueve submuestras para un total de 108 placas evaluadas (54 por técnica).
El muestreo en campo se distribuyó de la siguiente forma: para los tratamientos CM-1 y CM-2 se tomaron en el lote 14, que fue inoculado con hongos micorrícico arbusculares al momento de la siembra de plántulas; para los tratamientos SM-1 y SM-2 las muestras obtenidas fueron en el lote 15, donde no se realizó inoculación.
Procesamiento de datos y diseño experimental
El ensayo se hizo en un diseño completamente al azar (DCA), con tres repeticiones por tratamiento. El análisis estadístico se realizó mediante el software R 4.1.2 (R Core Team, 2021). Se verifico la normalidad con un análisis de Kolmogórov-Smirnov. Para las variables normales se evaluó la homocedasticidad mediante un test Bartlett y en el caso de las variables no normales se realizó mediante un test de Levene. Las diferencias significativas se realizaron con un nivel de confianza del 95% mediante un test de Welch en el caso de normalidad y Yuen como análisis no paramétrico. Finalmente, para comparación de medias, se hizo el análisis post-hoc de Tukey y Kruskal-Wallis, para datos normales y no normales respectivamente (de Mendiburu, 2021; Mair y Wilcox, 2020).
RESULTADOS Y DISCUSIÓN
Los suelos del ensayo presentan dominancia de texturas franco-arcillosas, con drenaje interno moderado y externo bueno, nivel freático profundo (más de 80cm), sin limitantes físicas para el desarrollo del cultivo. Actividad biológica moderada al momento del muestreo de suelo, con diversidad de cobertura vegetal, donde las arvenses rastreras y de bajo porte son dominantes. Los resultados del análisis químico de los lotes de ensayo (lote 14 y 15) se presentan en la tabla 2.
| Resultado | |||
| Propiedades | Unidades | ||
| Lote 14 | Lote 15 | ||
| pH | 4,7 | 5 | 1:01 |
| MO | 1,2 | 0,9 | % |
| S | 19,4 | 28,4 | |
| mg* Kg-1 | |||
| P | 42,8 | 15,6 | |
| Ca | 8,9 | 9,1 | |
| Mg | 4,4 | 5 | |
| K | 1,2 | 0,9 | cmol*Kg-1 |
| Al+H | 1,3 | 1,1 | |
| CICe | 16 | 16,4 | |
| Fe | 210 | 194 | |
| Mn | 29 | 19,4 | |
| Cu | 4,9 | 4,6 | mg* Kg-1 |
| Zn | 3,7 | 2,5 | |
| B | 0,3 | 0,3 | |
Porcentaje de colonización PCOL
Con ambas técnicas fue posible identificar los PCOL en los dos lotes evaluados. Se identificaron diferencias significativas (FWelch, p-value<0.001), donde el menor valor lo presentó el SM-1 con el 46.8% siendo diferente estadísticamente a los demás tratamientos. El mayor valor lo presentó SM-2 con 90.2%, sin diferir con los tratamientos CM-1 y CM-2 (Figura 1).
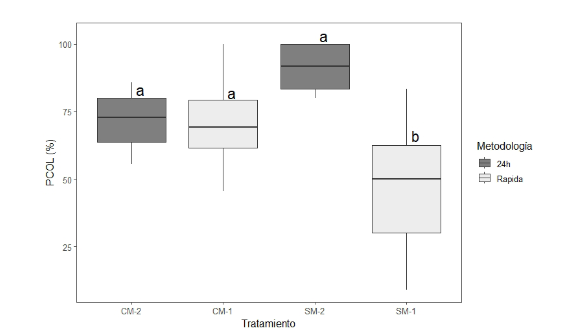
La presencia de colonización en los tratamientos SM-1 y SM-2, donde no hubo aplicación, puede deberse a micorrizas nativas, para lo cual, se debe realizar una nueva fase de muestreo y caracterización similar al reportado por Rodriguez Luqueño, (2021). Se resalta, además, que la riqueza y diversidad de especies podría estar influenciada no sólo por las características edafoclimáticas, sino también por otros factores, como la profundidad efectiva, usos del suelo y la diversidad de coberturas vegetales.
Para el caso del estudio, el lote 15, donde se estableció el SM-1 y SM-2, presentó mayor valor de pH y menor valor para P, Al y microelementos como Fe, Mn, Cu y Zn; lo que puede generar un ambiente con favorabilidad para la propagación de micorrizas (Wang et al., 2022).
Adicionalmente, se ha demostrado que el fósforo del suelo influye en las tasas de colonización y diversidad de HMA (Costa et al., 2008). Sagadin et al., (2018), identificaron que las tazas menores de colonización de micorrizas, estuvieron acompañadas por mayores niveles de carbono orgánico - nitrógeno total y niveles de fósforo casi cuatro veces mayores a los encontrados en el tratamiento con mayor colonización. Resaltando que la disponibilidad y forma del N y P influyen en los niveles de colonización y su disponibilidad presentan efectos negativos sobre el desarrollo de los HMA. En un trabajo relacionado con porcentajes de colonización en función de dosis de fertilizante fosforado, Bernal-Monterrosa y Cabrales- Herrera (2022), identificaron que la capacidad colonizadora de las micorrizas a las raíces es inversamente proporcional al contenido de fósforo soluble del suelo. En este sentido Mora y Leblanc, (2012) indican que, al presentar más contenidos de fósforo soluble en el suelo, las plantas no tienen la necesidad de establecer simbiosis con el HMA. La variabilidad espacial fisicoquímica del suelo y las condiciones favorables para el desarrollo y simbiosis del HMA pueden explicar el comportamiento de los resultados presentados en la Figura 1.
Porcentaje visible PVIS
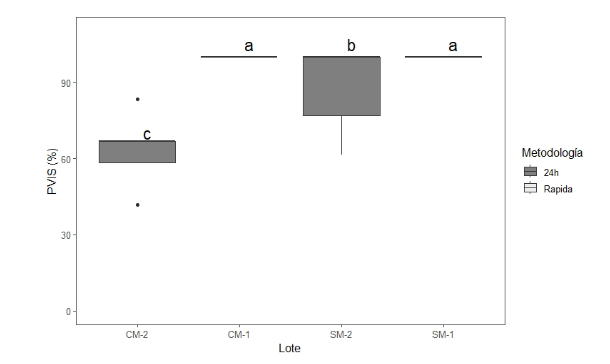
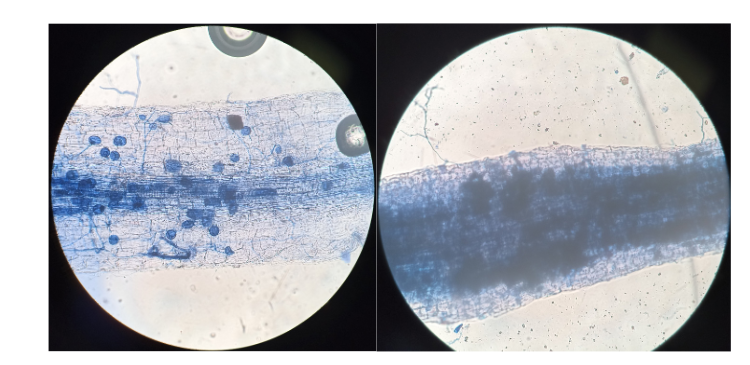
Se encontraron diferencias significativas en la visibilidad entre los métodos (Yuen, p-value<0.001) (Figura 2). El menor porcentaje de visibilidad lo presentó CM-2 con 63%, difiriendo estadísticamente de los demás tratamientos. Por otra parte, CM-1 y SM-1 presentaron un 100%, siendo similares estadísticamente. Identificando que la metodología “rápida” donde las muestras se someten a baño María presentan mejor visibilidad (Figura 3A) con respecto a la metodología “24 h” (Figura 3B).
En las metodologías usadas por múltiples investigadores para la determinación de simbiosis (Cottet et al., 2018), hay variación con respecto a la concentración de reactivos, temperatura y tiempo de exposición de las raíces al calor. Para clarificación, el uso de KOH varía en concentraciones de 0,01% a 15%, la temperatura de 25 °C (a temperatura ambiente) a 121 °C y el tiempo de exposición de 3 min a 72 h. Además, resaltan que con concentraciones del 10% de KOH y temperatura de 121 °C es posible reducir el tiempo de 3 a 10 min; pero genera daños a las células vegetales, ocasionando un deterioro parcial o total imposibilitando su visualización. Por otra parte, si se aumenta la concentración de KOH al 15% y la temperatura se reduce, se prolonga el tiempo de exposición en un rango de 24-72 horas; aunque en este caso las células no se destruyen, este método requiere mucho tiempo para ser terminado. Para el blanqueamiento, en diversas metodologías el HCl varia en concentraciones de 1% a 85% respectivamente, sin representar un daño para el material vegetal y mantiene su textura original.
En el caso de este ensayo, ninguna de las técnicas generó daños a la estructura de las células, pero se dificulto la visualización del material con los tratamientos CM-2 y SM-2 (método 24 h). Esto pudo deberse a factores como a) no presentó decoloración adecuada debido al tamaño y estructura de la raíz, b) exposición del material durante mucho tiempo al azul de tripán y c) necesidad obligada de sometimiento a calor en baño María para favorecer la decoloración y tinción de raíces en banano.
Número de vesículas NVES y número de arbúsculos NARB
Con ambas técnicas fue posible identificar las estructuras de las micorrizas. En NVES el valor se encontró entre 215,7 y 705,0 vesículas/placa para los tratamientos SM-1 y CM-1, respectivamente, sin presentar diferencias significativas; mientras que en NARB los valores estuvieron entre 12,1 arbúsculos/placa para SM-1 y 338,0 arbúsculos/placa para SM-2, encontrando diferencias significativas (FWelch, p-value<0.001) (Figura 4).
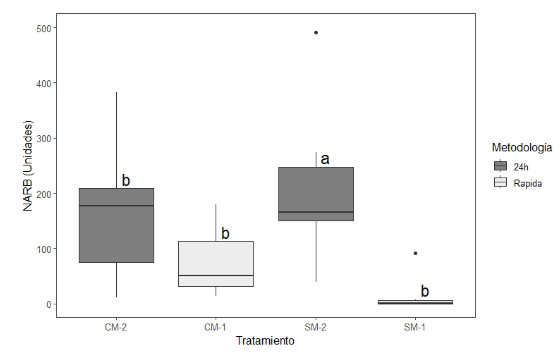
En cuanto a las estructuras arbusculares, las diferencias significativas pueden deberse a que la frecuencia de aparición de arbúsculos está influenciado por las condiciones fisicoquimicas edáficas y a la micotroficidad de la planta, lo que puede explicar la presencia y variabilidad temporal - espacial de estas estructuras (Di Barbaro et al., 2017). Adicionalmente, presentan un periodo de vida corta (Pérez y Vertel, 2010), Muñoz-Márquez et al. (2009) señalan que estas estructuras tienen un periodo de vida de aproximadamente dos semanas.
El cultivo de banano presenta gran capacidad para beneficiarse de la simbiosis micorrícica desde las primeras fases de desarrollo, perdurando su efecto después de su trasplante a campo. Las mejoras en la nutrición y crecimiento del cultivo indican el potencial uso de estos hongos como biofertilizante (Jaizme-Vega et al., 2003), debido a lo cual, es importante identificar la metodología apropiada para la identificación de la simbiosis en banano y los respectivos ajustes a partir de la sustitución de reactivos con el fin de mejorar la practicidad, facilidad en replicación y disminución de riesgos al personal.
CONCLUSIONES
Para la identificación de colonización micorrícica en raíces de banano, es necesario el sometimiento a baño María, lo que favorece y agiliza el proceso de la decoloración y tinción, permitiendo optimizar los tiempos en montajes y obteniendo el mayor porcentaje de visibilidad de los hongos micorrícicos arbusculares.
REFERENCIAS
Aguilar-Ulloa, W., Arce-Acuña, P., Galiano-Murillo, F. y Torres-Cruz, T. J. 2016. Aislamiento de esporas y evaluación de métodos de inoculación en la producción de micorrizas en cultivos trampa. Revista Tecnología En Marcha 29(7): 5. https://doi.org/10.18845/tm. v29i7.2700
Aires-dos Santos, J., Silva-Lara, T., Santos-Correia, T. e da Silva-Sou- sa, L. 2020. Influência da densidade de esporos de fungos micorrízicos arbusculares nativos da Savana no desenvolvimento do milho (Zea mays). Revista Brasileira De Ciências Da Amazônia 9(4): 21–28. https://doi.org/10.4 7209/2317-5729.v.9.n.4.p.21-28
Bernal-Monterrosa, M. Á. 2020. Efecto de microorganismos eficientes y micorrizas en la fertilización fosfórica del banano en alta densidad bajo condiciones edafoclimáticas de Apartadó – Colombia [Facultad de Ciencias Agrícolas]. https:// repositorio.unicordoba.edu.co/handle/ ucordoba/289
Bernal-Monterrosa, M. Á. y Cabrales- Herrera, E. M. 2022. Respuesta del banano clon Valery en alta densidad a la inoculación con micorrizas y fósforo en Apartadó - Colombia. Revista U.D.C.A Actualidad y Divulgación Científica 25(2): 1–9. https://doi.org/10.31910/rudca.v25. n2.2022.1659
Bernal Monterrosa, M. y Delgado Bejarano, L. 2022. Proyección de rendimiento usando variables productivas y diversos tipos de semilla de banano (Musa spp.) en Turbo-Colombia. Ciencia y Agricultura 19(3). https://doi.org/10.19053/01228420. v19.n3.2022.14706
Carrillo-Saucedo, S. M., Puente- Rivera, J., Montes-Recinas, S. y Cruz-Ortega, R. 2022. Las micorrizas como una herramienta para la restauración ecológica. Acta Botánica Mexicana 129. https://doi.org/10.21829/ abm129.2022.1932
Costa, T. A., Pintro, J. C., Silva, E. S. e Gomes da Costa, S. M. 2008. Influência da inoculação de fungos micorrízicos arbusculares, da acidez do solo e de fontes de fósforo no crescimento do milho. Acta Scientiarum. Agronomy 24: 1583. https://doi.org/10.4025/actasciagron. v24i0.2425
Cottet, A. C., Scervino, J. M. and Messuti, M. I. 2018. An improved staining protocol for the assessment of arbuscular mycorrhizal in bryophytes. Boletín de La Sociedad Argentina de Botánica 53(2): 201–206. http://scielo. org.ar/scielo.php?script=sci_arttext&pi- d=S1851-23722018000200006
de Mendiburu, F. 2021. agricolae: Statistical Procedures for Agricultural Research. https://cran.r-project.org/packa- ge=agricolae
Di Barbaro, G., Andrada, H., González Basso, V., Alurralde, A. L., Del Valle, E. y Brandán de Weht, C. 2017. Micorrizas arbusculares y hongos septados oscuros nativos en topinambur (Helianthus tuberosus L.) en Catamarca, Argentina. RevistadeCienciasAgrícolas34(2):98–106. https://doi.org/10.22267/rcia.173402.75
Ducousso-Détrez, A., Raveau, R., Fontaine, J., Hijri, M. and Lounès-Hadj Sahraoui, A. 2022. Glomerales Dominate Arbuscular Mycorrhizal Fungal Communities Associated with Spontaneous Plants in Phosphate-Rich Soils of Former Rock Phosphate Mining Sites. Microorganisms 10(12): 2406. https:// doi.org/10.3390/microorganisms10122406
Gonzalez, M., Ruscitti, M., Arango, C. y Pastorino, G. 2018. Micorrizas arbusculares y la restauración de ecosistemas degradados. Libros de Cátedra 52–63.
Instituto de Hidrología Meteorología y Estudios Ambientales (IDEAM). 2022. Promedios climatológicos. www.ideam. gov.co/web/tiempo-y-clima/clima
Instituto Geográfico Agustín Codazzi (IGAC). 2006. Métodos analíticos del laboratorio de suelos. Subdirección de agrología.
Instituto Geográfico Agustín Codazzi (IGAC). 2007. Estudio Semidetallado de Suelos de las Áreas potencialmente agrícolas. Urabá, Departamento de Antioquia.
Jaizme-Vega, M. C., Rodríguez-Romero, A. S., Marín Hermoso, C. y Declerck, S. 2003. Growth of micropropagated bananas colonized by root-organ culture produced arbuscular mycorrhizal fungi entrapped in Ca-alginate beads. Plant and Soil 254(2): 329–335. https://doi.org/10.1023/A:1025523632413
Kasaka, D., Onautshu, O., Muliwambene, K., Lebisabo, B., Katho, G., Baert, G., Swennen, R., Haesaert, G. and Dhed’a, D. 2022. Influence of Agrosystems on the Diversity of Mycorrhizae under Plan- tain Banana Cultivation in the Forest Region of Kisangani (Tshopo Province, DR Congo). Journal of Agriculture and Ecology Research International 23: 72–84. https:// doi.org/10.9734/jaeri/2022/v23i330225
Lima, R. L. F. de A. 2020. Arbuscular mycorrhizae and phosphorus uptake in soils as a function of adsorption capacity and competition with microbiota. Revista Brasileira de Geografía Física 13(3): 1062–1079. https://doi. org/10.26848/rbgf.v13.3.p1062-1079
Liu, Z., Han, Y., Lai, F., Zhao, H. and Cao, J. 2022. Contribution of Arbuscular Mycorrhizal Fungal Communities to Soil Carbon Accumulation during the Development of Cunninghamia lanceolata Plantations. Forests 13(12): 2099. https:// doi.org/10.3390/f13122099
Mair, P. and Wilcox, R. 2020. Robust Statistical Methods in R Using the WRS2 Package. Behavior Research Methods, 52, 464–488.
Mira Castillo, J. J. y Sánchez Torres, J. D. 2013. Principios para la nutrición del cultivo de banano. http://hdl.handle. net/20.500.12324/12593
Mora, A. N. and Leblanc, H. 2012. Evaluación del uso de micorrizas arbusculares para disminuir la aplicación de fertilizantes fosforados en el cultivo del maíz. Tierra Tropical 8(2): 245–255. http:// dx.doi.org/10.13140/RG.2.1.1345.2002
Muñoz-Márquez, E., Macías-López, C., Franco-Ramírez, A., Sánchez- Chávez, E., Jiménez-Castro, J. and González-García, J. 2009. Identification and Natural Colonization of Mycorrhizal Arbuscular Fungi in Pecan Orchards. Terra Latinoamericana 27(4): 355–361. https:// www.scielo.org.mx/pdf/tl/v27n4/v27n4a10. pdf
Naranjo-Moran, J. A., Mora-González, A. F., Moina-Quimí, E., Ruíz-Barzola, O., Alvarado-Cadena, O., Calle-Delgado, P., Flores-Cedeño, J., Oviedo-Anchun- dia, J., y Senen Barcos-Arias, M. 2022. Comportamiento en la absorción de Na y Pb en plantas de cucurbitáceas e inoculación de micorrizas arbusculares nativas en especie tolerante y susceptible. Revista Internacional de Contaminación Ambiental 38 407–421. https://doi.org/10.20937/RICA.54023
Newsham, K. K., Goodall-Copestake, W. P., Ochyra, R. e Váňa, J. 2014. Mycothalli of the hepatic Barbilophozia hatcheri in antarctica: Distribution and identities of mycobionts. Fungal Ecology 11: 91–99. https://doi.org/10.1016/j.fune- co.2014.05.00
Pérez, A. y Vertel, M. 2010. Evaluación de la colonización de micorrizas arbusculares en pasto Bothriochloa pertusa (L) A. Camus. Rev. MVZ Córdoba 15(3): 2165–2174. https://doi.org/10.21897/rmvz.
Phillips, J. M. and Hayman, D. S. 1970. Improved procedures for clearing roots and staining parasitic and vesicular- arbuscular mycorrhizal fungi for rapid assessment of infection. Transactions of the British Mycological Society 55(1): 158-IN18. https://doi.org/10.1016/s0007- 1536(70)80110-3
R Core Team. 2021. R: A language and environment for statistical computing. R Foundation for Statistical Computing. https://www.r-project.org/
Rashad, Y. M., Fekry, W. M. E., Sleem, M. M. and Elazab, N. T. 2021. Effects of Mycorrhizal Colonization on Transcriptional Expression of the Responsive Factor JERF3 and Stress- Responsive Genes in Banana Plantlets in Response to Combined Biotic and Abiotic Stresses. Frontiers in Plant Science, 12: 1–15. https://doi.org/10.3389/ fpls.2021.742628
Ren, W., Zhang, H., Jin, X., Huang, H., Zhou, L., Xu, T. and Tang, M. 2022. Pb Transfer Preference of Arbuscular Mycorrhizal Fungus Rhizophagus irregularis in Morus alba under Different Light Intensities. Journal of Fungi 8(11): 1224. https://doi.org/10.3390/jof8111224
Rodríguez-Yon, Y., Arias Pérez, L., Medina Carmona, A., Mujica Pérez, Y., Medina García, L. R. y Fernández Suárez, K. 2015. Alternativa De La Técnica De Tinción Para Determinar La Colonización Micorrízica. Cultivos Tropica- les 36(2): 18–21. http://scielo.sld. cu/scielo.php?script=sci_art text&pi- d=S0258-59362015000200003&ln-g=es&nrm=iso
Rodriguez Luqueño, M. E. 2021. Evaluación de micorrizas arbusculares nativas del estado de Morelos en el desarrollo de plantas de caña de azúcar y en el biocontrol de Fusarium andiyazi. http://riaa.uaem.mx/xmlui/bitstream/hand- le/20.500.12055/1677/ROLEQG00T.pd-f?sequence=1
Sagadin, M. B., Monteoliva, M. I., Luna, C. M. y Cabello, M. N. 2018. Diversidad e infectividad de hongos micorrícicos arbusculares nativos provenientes de algarrobales del Parque Chaqueño argentino con características edafoclimáticas contrastantes. AgriScientia, 35(2): 19. https://doi.org/10.31047/1668.298x.v35.n2.21001
Sánchez de Prager, M., Posada, R. H., Velásquez Pomar, D. y Narvaez Castillo, M. 2010. Metodologías básicas para el trabajo con micorriza arbuscular y hongos formadores de micorriza arbuscular. ISBN: 978-958-8095- 60-8
Sepúlveda Vargas, R. D. 2020. Economía y Agroecología. Construyendo alternativas al desarrollo rural. In Economíay Agroecología. Construyendo alter- nativas al desarrollo rural. https://doi. org/10.18566/978-958-764-910-9
Simó-González, J., Rivera-Espinosa, R. and Alonso, G. M. 2020. The integration of AMF inoculants, green manure and organo mineral fertilization, in banana plantations on calcic haplic phaeozems. Tropical and Subtropical Agroecosystems 23(1).
Soroa-Bell, M., Hernández-Fernández, A., Soto-Carreño, F. y Terry-Alfonso, E. 2009. Identificación de algunas especies de microorganismos benéficos en la rizosfera de gerbera y su efecto en la productividad. Revista Chapingo Serie Horticultura 15(2): 41–48. https://www.scielo.org.mx/scielo. php?pid=S1027-152X2009000400007&s-cript=sci_abstract
Vallejos-Torres, G., Sánchez, T., García, M. A., Trigoso, M. y Arévalo, L. A. 2019. Efecto de hongos formadores de micorrizas arbusculares en clones de Coffea arabica, variedad caturra en Perú. Acta Agronómica 68(4): 278–284. https://doi.org/10.15446/ acag.v68n4.72117
Vargas, R. y Araya, M. 2018. Contenido de raíces en plantaciones comerciales de banano muestreadas en el intermedio madre hijo y frente del hijo de sucesión. Corbana 44(64): 97–124. https://n9.cl/sj- ceo%0A
Wang, Q., Pan, J., Ke, Y., Yu, S., Murray, P. J., Luo, T., Zhang, L. and Liu, W. 2022. Impact of Aspect on Arbuscular Mycorrhizal Fungal Diversity and Community Composition in a Natural Toona ciliata var. pubescens Forest in Subtropical China. Forests, 13(12): 2100. https://doi.org/10.3390/f13122100
Notas

